 |
 |
 |
 |
|
||||||||||||||||||||
 |
 |
 |
|
|||||||||||||||||||||
Дорогие участники олимпиады!
Представляем вам вопросы 2 тура химической олимпиады. Вспомним некоторые открытия и изобретения, стимулировавшие развитие химии в старые времена и способствующие развитию и практическому использованию химии в настоящее время. Часть вопросов олимпиады для учащихся 7-9 классов отражают достижения начального этапа истории аналитических методов в химии, которые используются и ныне.
Для старшеклассников включены вопросы исторического характера, а также показаны достижения современной химии.
Как всегда, просим быть лаконичными, отвечать на конкретно поставленные вопросы. Творческое задание является общим для всех участников этого тура олимпиады. Лучшие ответы будут выставлены на нашем сайте.
Загрузить работы через online систему.
 1. Кем и когда был предложен метод определения молекулярных "весов" газообразных веществ не-посредственно по их относительной плотности:
1. Кем и когда был предложен метод определения молекулярных "весов" газообразных веществ не-посредственно по их относительной плотности:
1) M=29Dвоздух и 2) M=2DH2 ?
 2. «Изобретатель кухонной плиты, один из первых исследователей прочности нитей на разрыв и теплозащитных свойств одежды, пропагандировавший кофе как стимулирующий заменитель алкоголя (придумал кофейник с ситечком), ввел в Баварии употребление картофеля и т.д.» Кто это? Какой прибор был изобретен им для изучения реакций горения?
2. «Изобретатель кухонной плиты, один из первых исследователей прочности нитей на разрыв и теплозащитных свойств одежды, пропагандировавший кофе как стимулирующий заменитель алкоголя (придумал кофейник с ситечком), ввел в Баварии употребление картофеля и т.д.» Кто это? Какой прибор был изобретен им для изучения реакций горения?
 3. В какие времена в русском языке появились в употреблении такие термины и названия как: термометр, барометр, градус, атмосфера и др. Ответ: 1) 2) 3) 4)
3. В какие времена в русском языке появились в употреблении такие термины и названия как: термометр, барометр, градус, атмосфера и др. Ответ: 1) 2) 3) 4)
 4. Как можно получить этот раствор:
4. Как можно получить этот раствор:
= KCl + KOCl + H2O ? Как его называют? Для чего используют? Впишите левую часть уравнения.
 5. Для растворения нерастворимых осадков в аналитической химии используют разные подходы. В чем сущность примеров, приведенных ниже:
5. Для растворения нерастворимых осадков в аналитической химии используют разные подходы. В чем сущность примеров, приведенных ниже:
Для растворения нерастворимых осадков в аналитической химии используют разные подходы. В чем сущность примеров, приведенных ниже:
1) AgClт + NH3 =
2) CaC2O4· H2O + H+ =
3) СuS(k) + HNO3 =
СuS(k) + HCl =
MnO2(k) + HCl =
MnO2(k) + HNO3 =
Все ли превращения возможны в п.3, если используются конц. кислоты?
Допишите уравнения реакций.
 6. В 1726 году во Французскую академию была представлена диссертация, темой которой была концентрация уксуса: «Я отбирал от каждого типа уксуса около 2 драхм, помещал пробу в стакан и точно взвешивал. Затем я добавлял тонко измельченный сухой поташ до прекращения выделения пузырьков газа, вследствие чего кислота уксуса исчезала, и раствор становился соленым. Когда выделение газа прекращалось, я определил силу уксуса по количеству поташа, израсходованного на поглощение кислоты…» Кто автор диссертации? На какой реакции основано определение концентрации раствора уксусной кислоты? Что является своеобразным индикатором этой реакции, а что «стандартным раствором»?
6. В 1726 году во Французскую академию была представлена диссертация, темой которой была концентрация уксуса: «Я отбирал от каждого типа уксуса около 2 драхм, помещал пробу в стакан и точно взвешивал. Затем я добавлял тонко измельченный сухой поташ до прекращения выделения пузырьков газа, вследствие чего кислота уксуса исчезала, и раствор становился соленым. Когда выделение газа прекращалось, я определил силу уксуса по количеству поташа, израсходованного на поглощение кислоты…» Кто автор диссертации? На какой реакции основано определение концентрации раствора уксусной кислоты? Что является своеобразным индикатором этой реакции, а что «стандартным раствором»?
 7.«Возьмите химический стакан и влейте в него пипеткой щелочной раствор… влейте в него столько раствора лакмуса, чтобы раствор стал отчетливо синим. … Когда точка насыщения будет пройдена, вино-красный цвет раствора перейдет в чисто красный, бумага станет красной и цвет ее уже не изменится…» Это выдержка из статьи. Кого?
7.«Возьмите химический стакан и влейте в него пипеткой щелочной раствор… влейте в него столько раствора лакмуса, чтобы раствор стал отчетливо синим. … Когда точка насыщения будет пройдена, вино-красный цвет раствора перейдет в чисто красный, бумага станет красной и цвет ее уже не изменится…» Это выдержка из статьи. Кого?
 8. Кто разработал первый метод определения растворенного в воде кислорода? Как происходило определение? Этим ученым была разработана оригинальная методика приготовления перманганата калия и для стандартизации ее он использовал струны, предназначенные для рояля, щавелевую кислоту или двойную соль – сульфат железа и аммония, которую он также получал особым способом. Как вы думаете, какова роль рояльных струн? Какие изобретения этого ученого вам известны?
8. Кто разработал первый метод определения растворенного в воде кислорода? Как происходило определение? Этим ученым была разработана оригинальная методика приготовления перманганата калия и для стандартизации ее он использовал струны, предназначенные для рояля, щавелевую кислоту или двойную соль – сульфат железа и аммония, которую он также получал особым способом. Как вы думаете, какова роль рояльных струн? Какие изобретения этого ученого вам известны?
У этого ученого был неуживчивый характер, именно поэтому Либих написал ему: «Вы вызывали бы к себе меньше неприязни, если бы постарались не задевать постоянно других».
 9. «Чтобы разжечь огонь, нужно три полена». Какой смысл заложен в этом выражении?
9. «Чтобы разжечь огонь, нужно три полена». Какой смысл заложен в этом выражении?
 10. Возьмите свечу, бывшую в употреблении и зажгите ее. Опишите наблюдения, дайте им объяснения.
10. Возьмите свечу, бывшую в употреблении и зажгите ее. Опишите наблюдения, дайте им объяснения.
 1. Всегда ли прав В.В. Марковников, а если не прав, то почему? Допишите следующие уравнения реакций:
1. Всегда ли прав В.В. Марковников, а если не прав, то почему? Допишите следующие уравнения реакций:
1. CH2=CH-COOH + NH3 →
2. CH2=CH-COOH + H2O →
3. CH2=CH-CHO + HBr →
4. CH2=CH-CCl3 + HBr →
5. (CH3)2C=CH + HCl→
 2. Кто впервые применил контактно-каталитический метод окисления метанола кислородом воздуха? Приведите уравнение реакции. Какое отношение этот ученый имеет: 1) к Марковникову, 2) к Костроме, 3) к Харькову? Костромичи и Харьковчане можете получить дополнительно 3 балла за дополнительную информацию об этом ученом и иллюстрациями.
2. Кто впервые применил контактно-каталитический метод окисления метанола кислородом воздуха? Приведите уравнение реакции. Какое отношение этот ученый имеет: 1) к Марковникову, 2) к Костроме, 3) к Харькову? Костромичи и Харьковчане можете получить дополнительно 3 балла за дополнительную информацию об этом ученом и иллюстрациями.
 3. Метан, этанол, изопропанол, глицерин, ацетон и н-бутанол, кислоты: уксусная и молочная, (акриловая) – все эти вещества могут быть получены из одного с помощью биокатализа. Какого? Как получают это вещество? Из каких источников?
3. Метан, этанол, изопропанол, глицерин, ацетон и н-бутанол, кислоты: уксусная и молочная, (акриловая) – все эти вещества могут быть получены из одного с помощью биокатализа. Какого? Как получают это вещество? Из каких источников?
 4. Какими свойствами может обладать полимер, имеющий следующую структуру:
4. Какими свойствами может обладать полимер, имеющий следующую структуру:
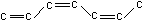
Как он называется? Каковы особенности его структуры?
 5. Как называется первый состоящий из неметаллических атомов ковалентно связанный полимер, обнаруживающий сверхпроводимость?
5. Как называется первый состоящий из неметаллических атомов ковалентно связанный полимер, обнаруживающий сверхпроводимость?
 6. 1. Может ли быть снег из этана? 2. Если да, то как он может образоваться (приведите схему образования) и где? 3. Если нет, то почему?
6. 1. Может ли быть снег из этана? 2. Если да, то как он может образоваться (приведите схему образования) и где? 3. Если нет, то почему?
 7. Найдите соответствие между учеными, сделавшими открытиями (К.С. Кирхгоф, А.М. Бутлеров, Фишер) и следующими названиями: D-фруктоза и L-фруктоза, акроза, метиленитан, крахмал, глюкоза.
7. Найдите соответствие между учеными, сделавшими открытиями (К.С. Кирхгоф, А.М. Бутлеров, Фишер) и следующими названиями: D-фруктоза и L-фруктоза, акроза, метиленитан, крахмал, глюкоза.
 8.
8.
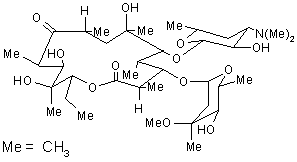
Это молекула эритромицина. Лауреат Нобелевской премии Р. Вудворд назвал это соединение «безнадежно сложным» для лабораторного синтеза.
1. Как вы думаете почему? (Дайте краткое обоснование).
2. Определите число асимметрических атомов «С» в этой молекуле.
3. Учитывая, что число стереоизомеров определяется формулой 2n, где n равно числу асимметрических атомов 2С», определите число возможных стереоизомерных структур.
 9. Как можно получить золотой кирпич стоимостью всего лишь 0,3 цента? Для чего нужны такие золотые (или иные) «кирпичи» в химии?
9. Как можно получить золотой кирпич стоимостью всего лишь 0,3 цента? Для чего нужны такие золотые (или иные) «кирпичи» в химии?
 10. В 1962-1967 гг. были открыты органические вещества, способные к комплексообразованию ионов металлов. 1. Кто сделал это открытие? 2. Как называются эти соединения? 3. Что такое «пурпурный» бензол?
10. В 1962-1967 гг. были открыты органические вещества, способные к комплексообразованию ионов металлов. 1. Кто сделал это открытие? 2. Как называются эти соединения? 3. Что такое «пурпурный» бензол?
«Периодическая систем элементов Д.И. Менделеева».
Суть задания: в творческой форме (рассказ, стихотворение, рисунок и т.д.) расскажите об элементе (история открытия) или простом веществе (особенности свойств, например). Ваш игровой номер (1-56, 72-80) – это порядковый номер элемента, о котором вам следует рассказать. Участники, имеющие игровые номера 57-71 и 81-99 рассказывают об элементах, имеющих порядковый номер, рассчитанный по формуле (100 – игровой номер команды). Участники, имеющие игровые номера из трех чисел, выбирают элементы с порядковыми номерами, соответствующими первым двум цифрам игрового номера, например, игровой номер 123, следовательно, элемент имеет порядковый номер 12.
Игровой номер рассматривается без префикса "7х", общего для всех команд.
Не стремитесь рассказать все, что можно найти об элементе или веществе. Сделайте рассказ простым, занимательным, интересным для младших школьников. Если это будет сделано в виде презентаций, ограничиваем их число до двух.
Желаем успехов!
- Электронная прочта (e-mail): chemproject@edu.yar.ru
- Телефон: +7 (4852) 32-88-91, 30-29-62
- Координатор проекта: Левашова Алия Тагировна
| © ГУ ЯО "Центр телекоммуникаций и информационных систем в образовании" | |




