 |
 |
 |
 |
|
||||||||||||||||||||
 |
 |
 |
|
|||||||||||||||||||||
Уважаемые участники Интернет-проекта «Путешествие в мир химии»!
Предлагаем вам вопросы первого тура олимпиады, которые составлены из имеющихся в литературе задач и заданий, а также из материалов Региональной коллекции цифровых образовательных ресурсов – ЦОР (адрес коллекции: http://collection.edu.yar.ru/ ), которую вы можете использовать в поисках некоторых ответов. Вторая часть традиционно представляет собой творческое задание, ориентированное на использование ЦОР, или любых других ресурсов, имеющихся в вашем распоряжении (ссылка обязательна). Постарайтесь выполнить все рекомендации по оформлению ответов и творческого задания.
Желаем успехов.
ВНИМАНИЕ!
Задания проекта состоят из двух частей:
1) Викторина (вопросы)
2) Творческое задание
Ответы на задания проекта принимаются до 8 декабря 2009 г., 16-00 (время московское).
На вопросы викторины участники отвечают в режиме online.
( Для доступа к форме приема ответов используйте логин и пароль, полученные при регистрации.)
Результаты выполнения творческого задания необходимо оформить в виде презентации и загрузить файл через форму
загрузки в личном кабинете (по ссылке "Загрузить работы").
(Доступ к личному кабинету возможен с использованием логина и пароля, полученных при регистрации.)
Загружаемые файлы должны соответствовать техническим требованиям.
Перейти на вопросы для 10-11 классов
Задание 1
Выберите ответ. По шкале первого термометра Цельсия температуре кипения воды соответствовало:- сотое деление
- пятидесятое
- нулевое
- другое
Задание 2
Какая из реакций относится к реакциям соединения?- KOH + HCl →
- CaCO3 → t
- Na2CO3 + H2SO4 →
- CaO + H2O →
Задание 3.1
Допишите уравнение: 99Es + 2He = ?.В ответе укажите только правую часть уравнения.
- калифорний,
- фермий,
- менделевий,
- нобелий
Задание 3.2
Какой элемент имеет приведенную электронную конфигурацию: 1s22s22p63s23p63d104s24р6- неон,
- хлор,
- криптон,
- железо
Задание 3.3
Могут ли электроны иона Al3+ находиться на следующих орбиталях: а) 1p; б) 2p; в) 3d? Выберите правильный ответ: 1) в возбужденном состоянии, 2) да, 3) нет. Ответ дайте в виде соответствия: а-x, б-y, в-z (x, y, z- номер ответа 123).- а-2,
- б-2,
- в-1,
- нет правильного ответа
Задание 4
Хлор взаимодействует со следующими веществами:- Al, N2, HI;
- O2, NaBr, S;
- H2, Mg, KBr,
- Ne, N2, NaI.
Задание 5
Массовая доля фосфора в одном из его оксидов равна 56,36%. Плотность паров этого вещества по воздуху равна 7,58.Установите молекулярную формулу оксида.
- Р2О3,
- Р4О6,
- Р2О5,
- нет правильного ответа
Задание 6
При каком молярном соотношении оксида серы (IV) и аргона получается смесь, которая в два раза тяжелее воздуха?- 1:2,
- 2:1,
- 1:3,
- 3:1
Задание 7
Для восстановления 3,2 г оксида металла требуется 1,344 л водорода (н.у.).При растворении полученного металла в избытке соляной кислоты выделяется 0,896 л водорода (н.у.).
Определите, какой это металл?
- медь.
- алюминий,
- железо,
- натрий
Задание 8
Медную пластинку массой 20 г опустили в раствор нитрата ртути (II). Масса пластинки увеличилась на 2,73 г.После этого пластинку прокалили, и она приобрела первоначальный вид.
Как изменилась при этом масса пластинки?
- увеличилась на 1,27 г.,
- уменьшилась на 1,27 г.,
- увеличилась на 2,54 г.,
- уменьшилась на 2,54 г.
Задание 9
Химический анализ соединения азота с водородом, имеющего относительную молекулярную массу 32, показал, что массовая доля азота в соединении равна 66%.Докажите, что результаты анализа неверны.
Ответом служит определенное вами число атомов азота в молекуле вещества.
- 1,
- 1,51,
- 2,
- 3
Задание 10
Смесь кислорода и оксида углерода (IV) при 0 °С и Р=84,04 кПа находится в замкнутом реакторе объемом 13,5 л.После введения в систему свежеприготовленного СаО и длительной выдержки системы при 0 °С давление в системе понизилось до 50,42 кПа.
Определить состав исходной смеси.
- ν(О2) =0,1 моль, ν(СО2) =0,2 моль,
- ν(О2) =0,3 моль, ν(СО2) =0,1 моль,
- ν(О2) =0,3 моль, ν(СО2) =0,3 моль,
- ν(О2) =0,3 моль, ν(СО2) =0,2 моль
Творческое задание
Представить в виде презентации, состоящей как максимум из 5 слайдов линию времени, раскрывающую (в рамках изучаемого материала 7-9 классы) историческое развитие понятий кислота и основание.
Исключить анимации и использование формата pps. Использованные материалы (иллюстрации, задания) из Единой коллекции цифровых образовательных ресурсов сопровождать ссылкой на Карточку ресурса. Тексты из электронных учебников не присылать. Адрес коллекции: http://collection.edu.yar.ru/. Могут быть использованы любые, из имеющихся в вашем распоряжении, ресурсы.
Ответы команд принимаются в режиме online до 16 часов (мск) 8 декабря 2009 г.
Задание 1
Кто создал установку для непрерывной перегонки нефти? Познакомьтесь с установкой, найдя ответ в Региональной коллекции ЦОР.

- Менделеев,
- Шухов,
- Бейльштейн,
- Лермонтова
Задание 2
Исходя из имеющихся реактивов и оборудования (рисунок взят из Региональной коллекции ЦОР), назовите вещество, которое находится в баночке без названия (под стрелкой)?

- медь,
- железо,
- перманганат калия,
- оксид меди (II)
Задание 3
Органическое вещество массой 1,875 г занимает объем 1 л (н.у.). При сжигании 4,2 г этого вещества образуется 13,2 г СО2 и 5,4 г воды.Определите молекулярную формулу вещества.
- С2Н4
- С3Н6
- С2Н6
- С3Н8
Задание 4
Предельную одноосновную карбоновую кислоту массой 11 г растворили в воде.Для нейтрализации полученного раствора потребовалось 25 мл раствора гидроксида натрия, молярная концентрация которого 5 моль/л.
Определите формулу кислоты.
- НСООН
- СН3СООН
- С2Н5СООН
- С3Н7СООН
Задание 5
В органической химии имеются именные правила, использующиеся для определения направления реакций.Найдите соответствие между правилом:
1) правило Эльтекова,
2) правило Марковникова,
3) правило Зайцева,
4) правило Попова и формулой вещества, для которого применимо соответствующее правило:
1) метилэтилкетон, 2) бутанол-2, 3) 2-метилбутен-2, 4) 2-бутенол-2.
Ответом служит набор двузначащих цифр, отделенных запятой в порядке, определяемом порядком приведенных правил.
- 11, 22, 33, 44;
- 12, 22, 34, 43;
- 14, 23, 32, 41;
- 14, 21, 33, 41
Задание 6
Некоторые квасцы (кристаллогидраты состава А1+Б3+(SO4)2•12H2O) cодержат 51,76% кислорода и 4,53% водорода. Определите формулу квасцов.- А - калий, Б - иридий;
- А - аммоний, Б - железо;
- А - калий, Б - алюминий;
- А - аммоний, Б - иридий;
Задание 7
Известно, что в неподписанных, но пронумерованных чашках (1,2,3,4) находятся минеральные удобрения:
А-сульфат аммония, Б -суперфосфат, В -нитрат натрия и Г-сильвинит.
Вам предстоит подписать чашки, предварительно определив, какое вещество скрывается за номером.
В вашем распоряжении имеются следующие реагенты:
1) конц. серная кислота (H2SO4) и медь (Cu);
2) р-р хлорида бария (BaCl2);
3) р-р щелочи
4) р-р нитрата серебра AgNO3.
При использовании этих реагентов в некоторых случаях наблюдались следующие изменения реакционной смеси:
а) выпадает белый осадок,
б) белый творожистый осадок;
в) желтый осадок;
г) универсальная индикаторная бумага становится синей у отверстия пробирки,
д) наблюдается появление бурого газа;
г) выпадает желтый осадок.
Обнаруживаемые признаки реакций при действии на приготовленные растворы удобрений приведенных реагентов, указаны в таблице:
| Чашка 1 | Чашка 2 | Чашка 3 | Чашка 4 | Реагент |
| - | Бурый газ | - | - | Конц. H2SO4 + Cu |
| Белый осадок | - | Белый осадок | - | BaCl2 |
| Посинение у отверстия пробирки | - | - | - | p-p NaOH, t; универсальная индикаторная бумага |
| - | - | Желтый осадок | Белый творожистый осадок | AgNO3 |
- 1-А, 2-Г, 3-В, 4-Б;
- 1-В, 2-А, 3-Б, 4-Г;
- 1-А, 2-В, 3-Б, 4-Г;
- 1-А, 2-В, 3-Г, 4- Б;
Задание 8
Газообразное органическое вещество массой 1,24 г пропущено последовательно через трубки, заполненные оксидом меди (II) при 400 °С, оксидом фосфора (V) и твердым гидроксидом калия, нанесенными на инертный носитель и взятыми в избытке. Масса первой трубки уменьшилась на 2,88 г, а массы второй и третьей трубок возросли, соответственно, на 0,2 г и 1,76 г. После пропускания газа через трубки было получено 54 мл газа при 25 °С и 95 кПа.Установите состав исходного вещества, назовите его.
- С3Н8 – пропан,
- СН5N - метиламин,
- С3Н6 - пропен;
- С2Н6О - диметиловый эфир.
Задание 9.1
Допишите уравнения окислительно-восстановительных реакций, расставьте коэффициенты. Выберите правильный ответ, в котором указан коэффициент для открытого, в правой части уравнения, вещества.
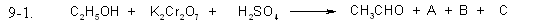
- 1
- 2
- 3
- 4
Задание 9.2
Допишите уравнения окислительно-восстановительных реакций, расставьте коэффициенты. Выберите правильный ответ, в котором указан коэффициент для открытого, в правой части уравнения, вещества.
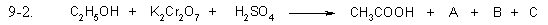
- 3
- 5
- 7
- 9
Задание 9.3
Допишите уравнения окислительно-восстановительных реакций, расставьте коэффициенты. Выберите правильный ответ, в котором указан коэффициент для открытого, в правой части уравнения, вещества.
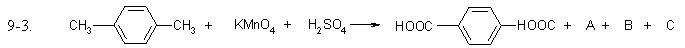
- 2
- 3
- 4
- 5
Задание 9.4
Допишите уравнения окислительно-восстановительных реакций, расставьте коэффициенты. Выберите правильный ответ, в котором указан коэффициент для открытого, в правой части уравнения, вещества.
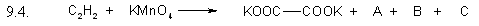
- 1
- 2
- 3
- 4
Задание 9.5
Допишите уравнения окислительно-восстановительных реакций, расставьте коэффициенты. Выберите правильный ответ, в котором указан коэффициент для открытого, в правой части уравнения, вещества.
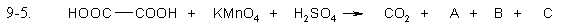
- 3
- 7
- 10
- 12
Задание 9.6
Допишите уравнения окислительно-восстановительных реакций, расставьте коэффициенты. Выберите правильный ответ, в котором указан коэффициент для открытого, в правой части уравнения, вещества.
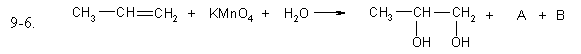
- 3
- 4
- 5
- 6
Задание 9.7
Допишите уравнения окислительно-восстановительных реакций, расставьте коэффициенты. Выберите правильный ответ, в котором указан коэффициент для открытого, в правой части уравнения, вещества.
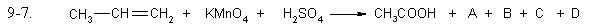
- 1
- 2
- 3
- 4
Задание 10
В колбе нагрели 0,18 г простого вещества с избытком концентрированной серной кислоты. Газообразные продукты реакции пропустили в избыток раствора гидроксида кальция, при этом выпало 5,1 г осадка. Определите исходное вещество. Для нахождения ответа составьте уравнения реакций и выполните расчеты.- медь,
- углерод,
- сера,
- кремний.
Творческое задание.
Представить в виде презентации, состоящей как максимум из 5 слайдов линию времени, раскрывающую (в рамках изучаемого материала 10-11 классы) историческое развитие понятий кислота и основание. Исключить анимации и использование формата pps. Использованные материалы (иллюстрации, задания) из Единой коллекции цифровых образовательных ресурсов сопровождать ссылкой на Карточку ресурса. Тексты из электронных учебников не присылать. Собственная пояснительная записка может состоять только из 1 страницы текста. Адрес коллекции, которую вы можете использовать для поиска: http://collection.edu.yar.ru/
Ответы команд принимаются в режиме online до 16 часов (мск) 8 декабря 2009 г.
- Электронная прочта (e-mail): chemproject@edu.yar.ru
- Телефон: (4852) 32-88-91, 30-29-62
- Координатор проекта: Богомолов Юрий Викторович
| © ГУ ЯО "Центр телекоммуникаций и информационных систем в образовании" | |





