1. К капле ртути, находящейся в пробирке под водой добавили некий раствор и увидели красивое зрелище, которое напоминало рост веток. Какой раствор был прилит, и что произошло при этом? Опишите с помощью уравнения реакции. 2 балла.
Ответ: к ртути был добавлен раствор нитрата серебра, в результате произошла реакция 2AgNO3 + Hg = 2Agv + Hg(NO3)2. выделяющееся серебро образует на капле ртути нитевидные кристаллы.
2. В средние века оксид цинка называли "философской шерстью". Почему? 1 балл.
Ответ: оксид цинка имеет волокнистое строение, с одной стороны, а с другой, принимает участие во многих непонятных реакциях. В качестве примера можно отнести амфотерность. Кроме того, вы можете провести простой эксперимент: погреть в пламени спиртовки оксид цинка. Обнаружите пожелтение его, а при охлаждении переход в первоначальное состояние. Найдите другие примеры "непонятных" реакций и попытайтесь их объяснить.
Д.И. Менделеев. Основы химии. Т.2. ОНТИ. Госхимтехиздат. Москва-Ленинград. 1934. С. 403. "Ископаемому сернистому цинку придано название "обманка", по той причине, что он, имея вид (значительную плотность 4,06 и т.п.) обычных металлических руд, "обманывал" первых рудокопов, так как не давал при простом обжигании на воздухе и сплавлении с углем металла, какой получался этим способом из всяких подобных руд. Получающуюся при этом белую окись цинка, образующуюся при горении паров цинка, тоже обозвали "nihil album" , т.е. "белым ничтожеством" за то же необычное отношение цинковой руды к обычным способам обработки руд".
3. Для чего использовали сплав, содержащий: Cu - 75-78 %, Sn - 20-21 %, Pb - 2-3 %? Иногда в этот сплав добавляли и серебро. Какое название имел этот сплав? Зачем добавляли серебро? 1 балл.
Ответ: это колокольная бронза, иначе ее называли "певчая медь", а серебро добавляли для звонкости.
4. Для чего черкесы на Кавказе в старину закапывали полосовое железо в землю? Приведите уравнения происходящих реакций. 2 балла.
Ответ: это способ превращения железа в сталь через ржавление:
Fe + 2H2O +3O2 > 4FeO(OH) (1)
В земле ржавчина адсорбировала органические вещества, которые после нагревания в горне и ковки выходили в поверхностный слой и упрочняли его:
(3Fe + C = Fe3C) (2), сообщая важную для изготовления сабель особую твердость.
5. Первое газообразное тело, которое человеку удалось обратить в жидкое состояние. 2 балла.
Ответ: двуокись серы, в 1780 году, французские ученые Гаспар Монж и Л. Клуэ. (Б.Н. Меншуткин. Курс общей химии. Л., Госхимиздат, 1933, стр. 510.
6. Применение растворимых бариевых солей для определения серной кислоты и ее солей впервые введено в химию... 1 балл.
Ответ: в 1780 г. шведским химиком Торнберном Бергманом, один из основоположников аналитической химии, разрабатывал методы качественного и количественного анализа. Определял реагенты как "вещества, которые при добавлении к раствору показывают присутствие посторонних веществ благодаря изменению цвета или чистоты тотчас же после добавления или спустя короткое время". Пример:
Купоросное масло (серная кислота). Будучи разбавлена , дает с барием белый осадок. Выделяет пузырьки газа из воды, содержащей карбонаты. Ф. Сабадвари, А. Робинсон. / История аналитической химии. М. Мир, 1984. С. 64.
7. Взаимодействие аммиака с хлороводородом впервые было обнаружено... 1 балл.
Ответ: Дж. Пристли в 1774 году (гашеная известь и нашатырь). Он же получил HCl, оксид азота, SiCl4, SO2. Исследовал свойства открытых им газов., был блестящим химиком- практиком. В эти же годы работали Г. Кавендиш и К.В. Шееле. Все они внесли наибольший вклад в развитие в развитие газового анализа, часто независимо друг от друга делали одни и те же открытия. Признание ими теории флогистона не позволило сделать им сделать правильных выводов из собственных открытий.
8. Бумагу, пропитанную лакмусом, впервые применил ... .... В году, а в 1871 году был открыт Адольфом Байером....2 балла.
Ответ: В 1667 г. Роберт Бойль впервые применил бумагу, пропитанную лакмусом. Фенолфталеин открыт Адольфом Байером в 1871 г.
9. Допишите уравнения реакций: (4 балла по 0.5 балла за каждое правильное уравнение реакции). В данном задании предполагалось использование конц. серной кислоты. Многие приводили примеры и с разбавленной серной кислотой, которые тоже оценивались по 0,5 балла за верно написанное уравнение реакции. В том случае, когда были даны ответы и с той и другой кислотой, учитывались все верные ответы, поэтому общий балл мог превосходить предполагаемый максимальный.
Ответ:
1) Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
2) 4 Mg + 5H2SO4 = H2S + 4MgSO4 + 4H2O
3) Zn + 2H2SO4 = ZnSO4 + SO2 + 2H2O
4) 3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O
5) 4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
6) 2NaCl(s) + H2SO4 = 2HCl↑ + Na2SO4
7) 8NaI(s) + 5H2SO4 = 4I2 + H2S + 4 Na2SO4 + 4H2O
10. Экспериментальная задача: В колбе находится конц. раствор NH4OH. В трех стаканчиках находятся неизвестные растворы, при добавлении к которым в стаканчиках появляется окрашивание: 1) белое, 2) синее, 3) красное. Какие вещества находились в стаканчиках в виде растворов?
Ответ: 3 балла по 1 баллу за правильный или близкий по смыслу ответ за каждый цвет, который окрашивает растворы в стаканчиках при добавлении конц. раствора гидроксида аммония.
1) Раствор Pb(NO3)2:
Pb(NO3)2 +2NH4OH(aq) → Pb(OH)2(s) + 2NH4NO3 (aq);
2) Раствор соли меди (II):
Cu2+(aq) + 4 NH4OH(aq) → [Cu(NH3)4](OH)2 (aq)
3) спиртовой раствор фенолфталеина.
Использован опыт из:
Chemical demonstrations: a sourcebook for teachers; Lee R. Summerlin, James L. Ealy, Jr.; 2nd ed.
1. Что такое красное турецкое масло? Для чего оно использовалось? 1 балл.
Ответ: Это натриевая соль сернокислого эфира рицинолевой кислоты. Рицинолевая кислота входит в состав касторового масла. Именно обработка серной кислотой при 20-30 градусах и последующая нейтрализация приводит к тем свойствам этого масла, которые вы нашли в литературе. Рицинолевая кислота имеет состав С18Н34О3 или СН3(СН2)5СН(ОН)СН2СН=СН(СН2)7СООН. В отличие от стеариновой (3%), олеиновой (3-9%), линолевой (2-3%), также входящим в состав касторового масла, рицинолевая кислота составляет от 80 до 85 % и имеет кроме карбоксильной группы еще и гидрокси-группу.
2. Пифагорейцы считали, что огонь состоит и мельчайших, а потому невидимых частиц, имеющих форму: а) тетраэдра, б) пирамиды; в) шара, г) куба. Какое отношение эта геометрическая фигура имеет к органической химии, в частности? Приведите пример вещества, молекула которого построена таким образом (без пояснений). 2 балла (0,5 балла за каждый пример)
Ответ: Пифагорейцы считали, что огонь состоит и мельчайших, а потому невидимых частиц, имеющих форму: а) тетраэдра, б) пирамиды; в) шара, г) куба.
Один из примеров тетраэдра: метан, тетрахлорметан и др.
3. Получение хлора из соляной кислоты и оксида марганца (IV) открыл... 0.5 балла.
Ответ: Карл Шееле, 1774 г.
4. "В назидание и предупреждение считаю нужным сообщить родителям и воспитателям случай, происшедший на днях в одном близком мне семействе. Четырехлетняя девочка неосторожно приблизилась к свече; вспыхнули волосы, а с ними и гребешок их придерживавший; последний горел настолько сильно, что не вдруг удалось потушить, и в результате получились ожоги, к счастию, не особенно значительные: вероятно, густота волос предохранила кожу, а иначе происшествие это могло бы окончиться весьма серьезно". А.М. Бутлеров. Как вы думаете, из какого материала был сделан гребешок? 1 балл.
Ответ: Продолжение письма в редакцию "Важное предупреждение" :
"Дело в том, что гребешок был из целлюлоида, той красивой массы, которая с большим успехом употребляется ныне, между прочим, для подделки кораллов. Вещество это общеизвестно, если не по имени, то по употреблению; но едва ли многие знают, что оно представляет смесь взрывчатой ваты (пироксилин, нитроцеллюлоза, фульмикотон) и камфоры: Употребление для детей изделий из нее требует поэтому большей осмотрительности или, еще лучше, должно быть совсем изгнано.". А.М. Бутлеров
5. Летом 1837 года в России было создано некое Московское общество, которое открыло первый завод по производству (Чего?). Попечителем этого общества император Николай I назначил графа Строганова, а завод был освобожден от уплаты налога на шесть лет. Как называлось общество? Что должен был производить завод? Книга по химии для домашнего чтения. Б.Д. Степин, Л.Ю. Аликберова. Изд. "Химия", 1994. 1 балл.
Ответ: Московское общество по производству свечей. Стеариновые свечи.
6. Какое явление является причиной того, что фруктозу нельзя отличить от глюкозы действием гидроксида меди (II) в щелочной среде при нагревании? Выберите ответ или проверьте экспериментально. 1. Мутаротация; 2) Эпимеризация; 3) Оптическая изомерия. 4) Ни одно из названных. 1 балл.
Ответ: В ответе достаточно было указать явление - это эпимеризация. Явление это основано на ендиольной таутомерии, происходящей в щелочной среде, что приводит к установлению равновесия между образующимися эпимерами - глюкозой, фруктозой и маннозой, отличающихся только конфигурацией второго атома углерода.
Схема эпимеризации (приведен участок структуры, в котором происходят изменения):
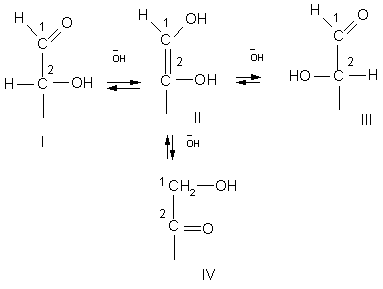
Структура II -ендиольная форма, через которую происходят взаимные превращения изомеров:
глюкозы (I), фруктозы (IV) и маннозы (III). Конфигурация 3-6 атомов углерода не изменяется.
7. В вашем распоряжении два органических вещества, пиррол и пирролидин и два реагента: а) конц. серная кислота; б) КОНТВ. Какие уравнения реакций невозможны и почему?
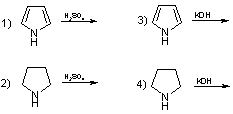
Ответ:
1) пиррол протонируется взрывообразно;
4) пирролидин проявляет свойства сильного основания.
Пиррол проявляет свойства ароматических соединений за счет сопряжения неподеленной электронной пары атома азота с диеновой системой цикла, образуя единую π-электронную систему, аналогичную бензольной, но отличающейся тем, что цикл 5-членный. В результате мезомерии электронная плотность смещена от азота в сторону циклической системы, что приводит к потере атомом азота способности протонироваться (нарушается стабильная ароматическая система), усиливается легкость протонирования α-положения относительно атома азота, что сопровождается значительным выделением энергии, обладает слабыми кислотными свойствами, такими, как фенол, что позволяет получать N-металлические производные, широко применяемые в синтезах (реакция 3) и невозможность протекания реакции (1).
Пирролидин, который можно получить при гидрировании пиррола проявляет свойства жирных аминов, т.е. является основанием (возможна реакция (2), а кислотные свойства слабы, поэтому в данных условиях осуществление реакции (4) не представляется возможным.
8. Найдите соответствие между уравнениями реакций и авторами их:
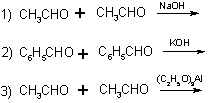
4) Канниццаро; 5) Тищенко; 6) Бородин-Вюрц. Раствор NaOH - разбавленный; КОН - концентрированный.
Ответ: 1) - 6); 1872 г.; 2) - 4); 1853 г.; 3) - 5) 1906 г.
9. Экспериментальная задача. Стоимость вопроса - 2 балла.
Налейте в бюретку 1 мл воды. Сосчитайте число капель вытекающей воды за 1 минуту из крана бюретки. Приготовьте разбавленный раствор мыла и поместите 1 мл этого раствора в ту же бюретку. Вновь приоткройте кран, чтобы раствор вытекал по каплям. Сосчитайте число капель, вытекающих за одну минуту. Объясните свои наблюдения.
Ответ: Число капель вытекающего мыльного раствора вдвое больше, чем чистой воды, скорость вытекания увеличивается из-за уменьшения поверхностного натяжения.
К сожалению, очень немного команд осуществило этот опыт, а ответ привели известный, поэтому максимальную оценку получили команды, которые доказали то, что эксперимент проведен.
10. Назовите продукты реакций: (аналогичные примеры приводятся в сборнике олимпиадных задач [9]).
1) Br-CH2-CH=CH2 + HCl →
2) H2N-CH2-CH=CH2 + HCl → или 2) CH3O-CH2-CH=CH2 + HCl →
3) CH3 - C(Br)=CH2 + HCl →
4) CH3 - C(NH2)=CH2 + HCl → или 4) CH3 - C(OCH3)=CH2 + HCl →
Для объяснения направления реакции графически изобразите смещение электронной плотности в молекулах исходных веществ.

В том случае, когда А - функциональная группа типа НО, NH2, Br, CH3O, то есть группа с гетероатомом, имеющим неподеленную электронную пару, тогда эта группа является акцепторной, если она отделена от двойной связи метиленовой группировкой. В этом случае А проявляет только отрицательный индуктивный эффект и смещает электронную плотность так, как показано выше. На концевом атоме углерода двойной связи возникает частичный положительный заряд, поэтому присоединение происходит как показано в уравнении. К такой системе неприложимо правило Марковникова, так как в нем речь идет только об углеводородах.
2) Иное дело, когда функциональная группа имеет гетероатом с неподеленной электронной парой непосредственно связана с атомом углерода, входящим в ненасыщенную систему (см. ниже). В этом случае функциональная группа кроме отрицательного индуктивного проявляет положительный мезомерный эффект. Именно это взаимодействие (мезомерный эффект) определяет распределение электронной плотности кратной связи (π-связь), что приводит к появлению частичного отрицательного заряда на концевом атоме «С» двойной связи и протеканию реакции присоединения следующим образом (и в этом случае нельзя использовать правило Марковникова):

Когда А - аминогруппа, реакция может осложняться протонированием аминогруппы:
- NH2 + H+ → - NH3+
Образующийся катион аммония не способен к мезомерии из-за потери НЭП, проявляет только отрицательный индуктивный эффект.
Учитывая вышесказанное ответы оценивались из 1 балла за правильный ответ, а дополнительно еще 2 балла добавлялись за учет протонирования аминогруппы.
Творческие задания
Максимальный балл, как и в предыдущем туре - 10.
Изготовление моделей приведено в форуме и в тех литературных ссылках, которые приведены.
Это задание оказалось очень трудным, поэтому оценка давалась и за понимание возможных изомерий, и за попытку сделать модели, даже если они делались иначе. Особенность этих моделей в том, что они дают очень наглядное представление именно о пространственной изомерии.
7-9 классы. Вся надежда была на 9-классников, которые должны иметь представление о теории гибридизации, а 7-8 классы могли собирать модели. Модель с одним атомом углерода, но с присоединенными разноцветными бутылками дает представление об асимметрическом атоме углерода (оптическая изомерия). Модель молекулы этана - конформационная изомерия.
10-11 классы. Два атома углерода в sp3- гибридизации и два атома углерода в sp2-гибридизации дают возможность проиллюстрировать и структурную и геометрическую изомерию. Будем надеяться, что вам захочется достроить модели, так как было задумано В.В. Самошиным и они помогут вам в изучении трудных вопросов гибридизации и изомерии, которые являются ключевыми в понимании органической химии.
Рекомендуемая литература:
1.Степин Б.Д., Аликберова Л.Ю. Книга по химии для домашнего чтения.-2-е изд.,- М.: Химия, 1995 г. - 400 с. (Научно-популярная библиотека школьника).
2. Биографии великих химиков. Редактор К. Хайниг. М. Мир. 1981.
3. В.А. Волков, Е.В. Вонский, Г.И. Кузнецова. Химики. Биографический справочник..Киев, "Наукова думка", 1984.
4. И.А. Леенсон. Занимательная химия. В двух частях /М. "Дрофа", 1996
5. Н.А. Фигуровский. История химии. М. Просвещение, 1979.
6. К. Манолов. Великие химики. В двух томах. М.: Мир, 1976-1977.
7. Orbital models made of plastic soda bottles / Vyacheslav V. Samoshin. - Chemistry everyday for eveveryone. JChemEd.chem.wisc.edu. Vol. 75 No. 1998. Jornal of Chemical Education. P. 985
8. Химический эксперимент в школе. 10 класс: учебно-мет. Пособие / О.С. Габриелян, Л.П. Ватлина.-М.: Дрофа, 2005.
9. Химия. 8-11 классы. Региональные олимпиады. 200-/2002/ авт-сост. О.С. Габриелян, А.Н. Прошлецов. - М.: Дрофа, 2005.
10. А.А. Кудрявцев. Составление химических уравнений: Учеб пособие . М.: Высш. Шк., 1991.
11. М. Любомудров. Федор Волков. Ленинград "Детская литература". 1983.
Со всеми вопросами обращайтесь:
E-mail